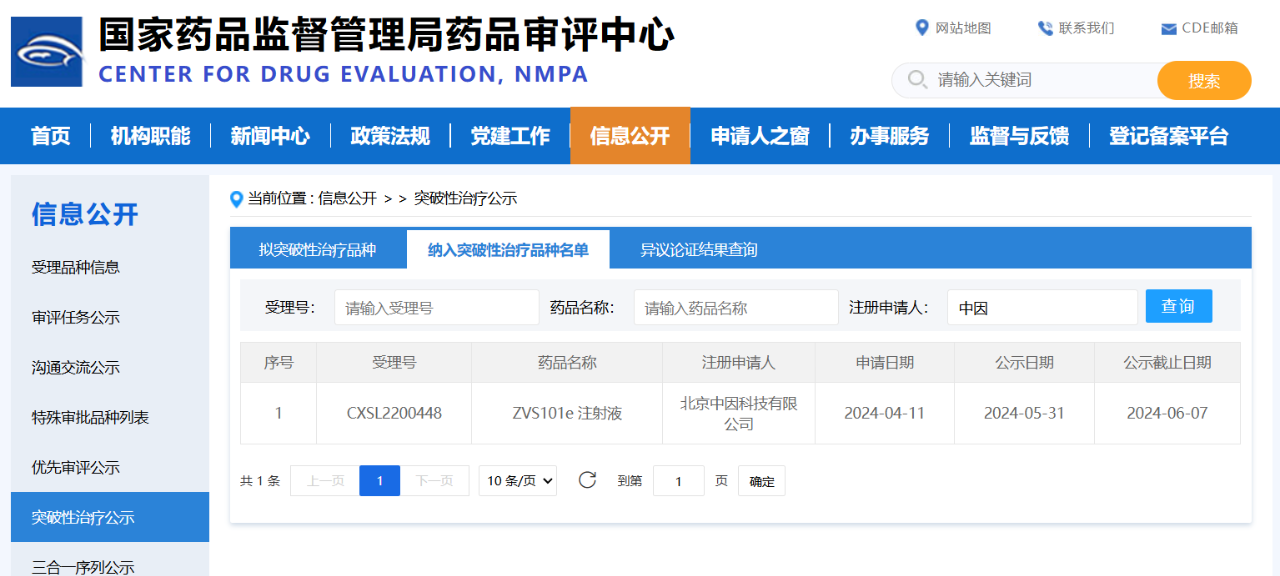
6月29日,根据国家药品监督管理局药品评审中心(CDE)官方网站显示,北京中因科技有限公司(以下简称中因科技)ZVS101e注射液已纳入突破性治疗品种名单,用于治疗结晶样视网膜变性(BCD)。该里程碑事件是ZVS101e注射液从科学理论论证到人体临床应用的重大突破,临床上安全和有效性结果也证明了ZVS101e注射液优秀的临床价值和未来上市的巨大潜力。
ZVS101e(rAAV8-hCYP4V2)研发理念由中因科技首席科学家、创始人杨丽萍研究员最早提出,经历十余年艰辛探索,在2021年首次开展研究者发起的临床试验,是国际范围内针对BCD疾病的第一个基因治疗临床试验(NCT04722107),同年获得美国FDA的孤儿药资格授权。2022年ZVS101e注射液获得中美Investigational New Drug(IND)批件,2023年2月完成I/Ⅱ期临床试验首例受试者入组,是世界范围内针对BCD开展的首个注册性临床试验。目前该药物已完成I/Ⅱ期临床试验,即将进入Ⅲ期临床试验阶段,有望为目前无药可治的BCD疾病带来突破性的治疗前景,从而为患者提供新的、潜在的治疗选择。

中因科技是眼科基因治疗引领者,专业从事遗传眼病基因诊断和基因治疗药物开发的国家高新技术企业,致力于为遗传性眼病患者提供精准诊断和治疗“一站式”服务。中因科技基于诊断平台建立遗传眼病数据库及大队列,总结出中国患者的突变频谱,为药物研发提供治疗靶点;在此基础上开发具有独立自主知识产权的药物,包括基因替代治疗和基因编辑治疗,力争实现“从零到一”的突破。目前已建立靶标筛选、基础研究、动物实验验证、干细胞验证、AAV病毒研发和生产、临床试验运营和药物注册申报等完整的药物开发体系。

北京首都科技发展集团有限公司(以下简称“首发展集团”)是北京市科委、中关村管委会履行国有资产出资人职责的国有独资公司。2019年,首发展旗下北京首科开阳创业投资中心(有限合伙)参与完成对中因科技的天使轮投资。
版权声明:
本文由“北京首都科技发展集团”公众号编辑,来源“中因科技”。