4月,魏文斌教授团队、杨丽萍研究员团队以及王立坤副研究员团队,在Nature子刊Signal Transduction and Targeted Therapy(IF=39.3)发表了“Gene replacement therapy in Bietti crystalline corneoretinal dystrophy: an open-label, single-arm, exploratory trial”的研究论文,报告北京中因科技有限公司(以下简称中因科技)ZVS101e注射液临床试验结果,结果显示ZVS101e注射液具有良好的安全性和卓越的有效性。

该研究为单臂、开放标签、探索性临床试验,共入组12例受试者,目前患者已随访180-365天,随访期间绝大多数的不良事件为轻度或中度,且大多数与手术或口服激素相关,未观察到药物相关严重不良事件及免疫毒性相关不良事件,表现出良好的安全性。
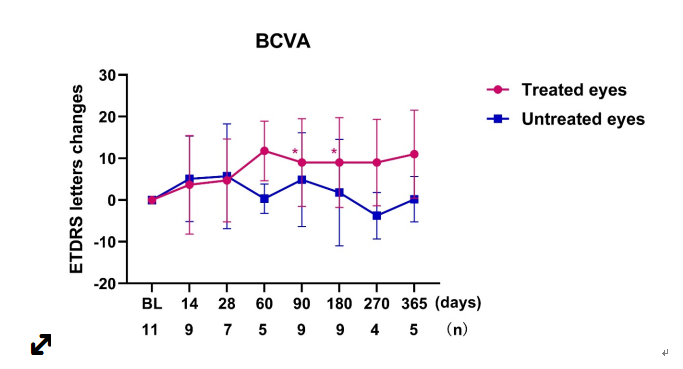
治疗后受试者最早术后2周出现视力改善,并维持至少1年。术后180天和365天,治疗眼BCVA平均较基线提高9.0和11.0个字母。术后365天,80%的受试者BCVA较基线提升,其中40%的受试者提高≥15个字母,具有显著的临床意义。表明ZVS101e基因治疗不仅阻止了BCD患者的视力下降,甚至逆转了患者进行性恶化的自然病程,在BCD治疗领域实现了突破性进展,具有重大意义。其他有效性指标均可见改善趋势,微视野平均光敏感度较基线改善,表明受试者的视野功能改善,视觉功能问卷综合得分较基线提高,其中一般视力和周边视力得分显著提高,表明受试者的视觉相关生活质量改善。此外,术后365天,100%受试者客观性视功能指标mfERG P1波振幅密度较基线提高,代表受试者视网膜细胞功能改善,表明受试者的视觉改善并非安慰剂效应。
ZVS101e(rAAV8-hCYP4V2)研发理念由杨丽萍研究员最早提出,经历十余年艰辛探索,在2021年首次开展研究者发起的临床试验,是国际范围内针对BCD疾病的第一个基因治疗临床试验(NCT04722107),同年获得美国FDA的孤儿药资格授权。2022年ZVS101e注射液获得中美IND批件,2023年2月完成I/II期临床试验首例受试者入组,是世界范围内针对BCD开展的首个注册性临床试验。目前该药物已完成I/II期临床试验,即将进入III期临床试验阶段,有望为目前无药可治的BCD疾病带来突破性的治疗前景,从而为患者提供新的、潜在的治疗选择。

中因科技是眼科基因治疗引领者,专业从事遗传眼病基因诊断和基因治疗药物开发的国家高新技术企业,致力于为遗传性眼病患者提供精准诊断和治疗“一站式”服务。中因科技基于诊断平台建立遗传眼病数据库及大队列,总结出中国患者的突变频谱,为药物研发提供治疗靶点;在此基础上开发具有独立自主知识产权的药物,包括基因替代治疗和基因编辑治疗,力争实现“从零到一”的突破。目前已建立靶标筛选、基础研究、动物实验验证、干细胞验证、AAV病毒研发和生产、临床试验运营和药物注册申报等完整的药物开发体系。

中因科技为首发展下属基金首科开阳投资企业,在首科开阳投资后,集团联合北京市科技金融促进会、北京创业孵育协会为投后项目举办专场路演等活动,多次为中因科技提供资本对接机会和渠道。
版权声明:
本文由“北京首都科技发展集团”公众号编辑,来源“ 中因科技”。